Теоретические основы химии. Валентность. Электроотрицательность. Степень окисления
Валентность
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов ![]()
2) неподеленных электронных пар на орбиталях валентных уровней ![]()
3) пустых электронных орбиталей валентного уровня ![]()
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
![]()
1s
Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
В основном состоянии электронная конфигурация внешнего уровня атома углерода выглядит так:
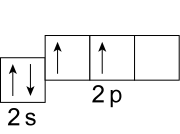
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако, атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
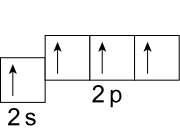
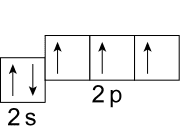
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
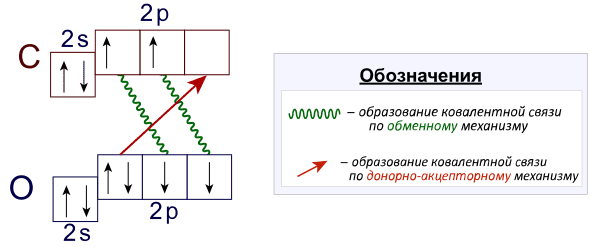
Резюмируя информацию по валентным возможностям атома углерода:
1) Для углерода возможны валентности II, III, IV
2) Наиболее распространенная валентность углерода в соединениях IV
3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ![]() ) предоставляет ее другому атому с вакантной (
) предоставляет ее другому атому с вакантной ( ![]() ) орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
) орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
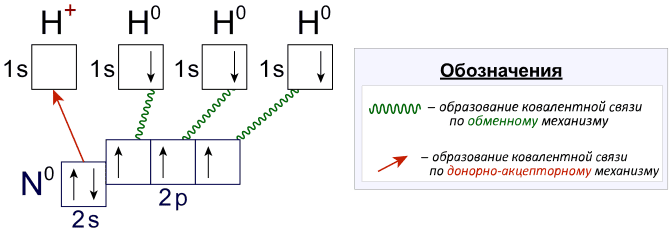
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
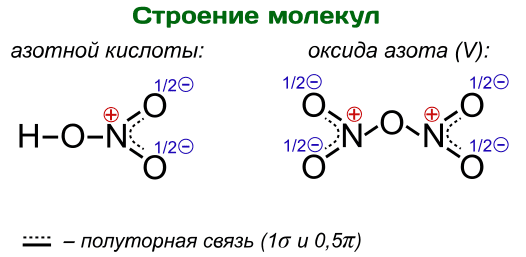
Пунктирной линией на иллюстрации изображена так называемая делокализованная π-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т.д.
Резюмируя информацию по валентным возможностям атома азота:
1) Для азота возможны валентности I, II, III и IV
2) Валентности V у азота не бывает!
3) В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
4) В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония NH4+, азотная кислота и д.р).
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
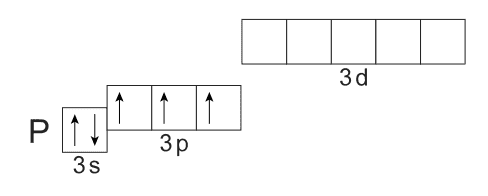
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d-подуровень с 5-ю вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s-орбитали:
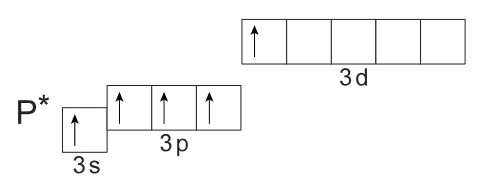
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
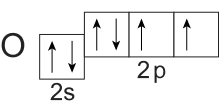
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d-подуровня, распаривание электронов s и p-орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Таким образом, кислород практически всегда имеет валентность, равную II, однако в некоторых частицах он трехвалентен, в частности, в молекуле угарного газа C≡O. В случае, когда кислород имеет валентность III, одна из ковалентных связей образована по донорно-акцепторному механизму.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
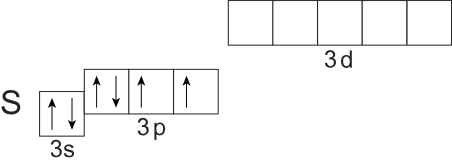
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H2S.
Как мы видим, у атома серы на внешнем уровне появляется d-подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
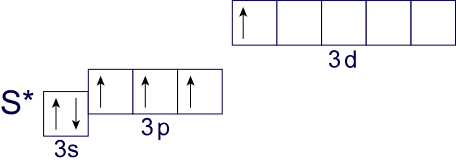
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO2, SF4, SOCl2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s-подуровне, внешний энергетический уровень приобретает конфигурацию:
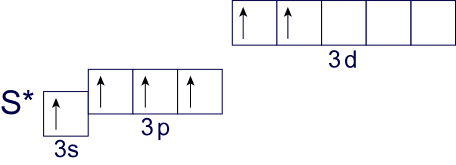
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO3, H2SO4, SO2Cl2 и т.д.
Электроотрицательность
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
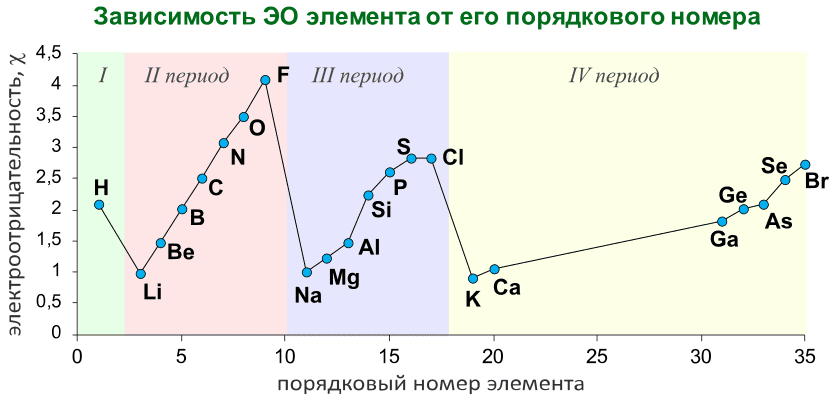
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
Элементы, проявляющие постоянную СО |
Значение постоянной СО этого элемента |
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr |
+1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd |
+2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
Элемент |
Степень окисления практически во всех соединениях |
Исключения |
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию!)
Химический элемент |
Номер группы |
Высшая степень окисления |
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | 0 |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Как найти степени окисления в неорганических соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
H2SO4
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF2). Расставим известные степени окисления:
H+12SO-24
Обозначим степень окисления серы как x:
H+12SxO-24
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
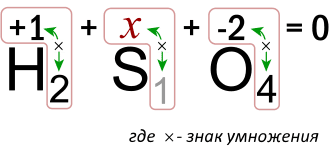
Т.е. мы получили следующее уравнение:
1 • 2 + x • 1 + (-2) • 4 = 0
2 + x - 8 = 0
x = 6
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
(NH4)2Cr2O7
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
(NH+14)2Cr2O-27
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH4+ (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH4+ , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH4+ и анионами Cr2O72-.
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Получаем два независимых уравнения:
x • 1 + 1 • 4 = 1 и y • 2 + (-2) • 7 = -2
x + 4 = 1 2y - 14 = -2
x = -3 y - 7 = -1
y = -6
Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определить степени окисления в органических соединениях
Степени окисления в органических соединениях требуется уметь расставлять для решения заданий ЕГЭ по химии, в которых дается цепочка превращений органических веществ, часть из которых неизвестна. На данный момент это задания номер 32.
Для определения степени окисления в органических соединениях существует два метода. Суть их одинакова, но выглядят применение данных методов по-разному.
Первый способ
Берем органическую молекулу, например, такого вещества, как 2-гидроксипропаналь
и изолируем друг от друга все фрагменты молекулы, содержащие по одному атому углерода следующим образом:
Суммарный заряд каждого такого блока принимаем равным нулю, как у отдельной молекулы. В органических соединениях водород всегда имеет степень окисления, равную +1, а кислород — -2. Обозначим степень окисления атома углерода в первом блоке переменной х. Таким образом, мы можем найти степень окисления первого атома углерода, решив уравнение:
x + 3∙(+1) = 0, где x – степень окисления атома углерода, +1 – степень окисления атома водорода, а 0 – заряд выбранного блока.
Решаем далее:
x + 3 = 0, отсюда x = -3.
Таким образом, степень окисления атома углерода в первом блоке равна -3.
Во второй блок, помимо одного атома углерода и двух атомов водорода, входит также и атом кислорода, который, как мы уже сказали, имеет в органических соединениях практически всегда степень окисления, равную -2. Как и в первом случае, обозначим степень окисления атома углерода второго блока через х, тогда получим следующее уравнение:
x+2∙(+1)+(-2) = 0, решая которое находим, что х = 0. Т.е. степень окисления второго атома углерода в молекуле равна нулю.
Третий блок состоит из одного атома углерода, одного атома водорода и одного атома кислорода. Аналогично составим уравнение:
x +1∙(-2)+ 1 = 0, отсюда х, то есть степень окисления атома углерода в третьем блоке равна +1.
Второй способ
Для того, чтобы его использовать, нужно нарисовать сначала развернутую структурную формулу органического вещества:
Под черточками между символами элементов понимают их общие электронные пары, которые между одинаковыми атомами можно считать распределенными поровну, а между разными – смещенными к одному из атомов, обладающему большей электроотрицательностью. Среди трех элементов С, Н и О наибольшую элетроотрицательность имеет кислород, затем углерод, а самое малое значение электроотрицательности у водорода. Поэтому, если показать стрелочкой смешение электронов в сторону более электроотрицательных атомов, мы получим следующую картинку:
Как можно заметить, между атомами углерода мы не стали рисовать стрелку, оставив обычную черточку, поскольку считается, что общая электронная пара между двумя атомами углерода практически не смещена ни к одному из них.
Будет интерпретировать последний рисунок следующим образом: каждый атом, из которого стрелка исходит, «теряет» один электрон, а каждый атом, в который стрелка входит, «принимает» электрон. При этом помним, что заряд электрона отрицателен и равен -1.
Таким образом, первому атому углерода достается от трех атомов водорода по одному электрону (три входящих стрелки), в результате чего он приобретает условный заряд, т.е. степень окисления, равную -3, а каждый атома водорода — +1 (по одной исходящей стрелке).
Второму атому углерода достается от «верхнего» атома водорода один электрон (стрелка от H к С), и еще один электрон атом углерода «теряет», передавая его атому кислорода (стрелка от С к О). Таким образом, в атом углерода «входит» один электрон и один из него «выходит». Поэтому степень окисления второго атома углерода равна 0, как в отдельном атоме.
К атому кислорода направлены две стрелки, значит, он имеет степень окисления, равную -2, а от всех атомов водорода исходит по одной стрелке. То есть степень окисления всех атомов водорода равна +1.
В последний атом углерода входит одна стрелка от Н и исходит две стрелки к О, таким образом, «входит» один электрон и «выходят» два. Значит, степень окисления равна +1.
Оба описанных метода весьма условны, как, собственно, и условно само понятие «степень окисления» в случае органических веществ. Тем не менее, в рамках школьной программы данные методы вполне справедливы и, главное, позволяют использовать их при расстановке коэффициентов в реакциях ОВР с органическими веществами.




